Física de la RM
Algunas pinceladas sobre su base física
Sergio Díaz Prados
R2 de Radiología del Hospital Virgen de las Nieves, Granada.
Fecha de publicación
17 de enero de 2025 a las 18:22
Imágenes de Física de la RM
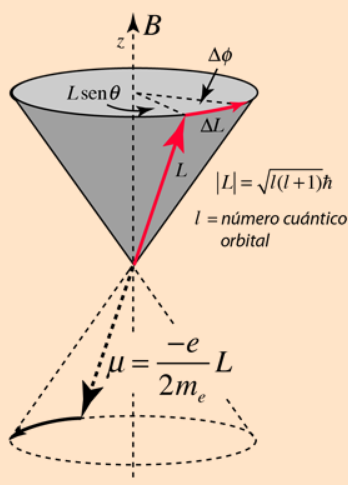
1 Precesión del protón según Ley de Larmor
Física de la RM
Principios básicos
1. PRINCIPIOS BÁSICOS:
¿QUÉ PROPIEDADES DE GIRO TIENE UN PROTÓN con MOVIMIENTO circular alrededor del eje del campo magnético principal (B₀). T?
1. Precesión:
- Tiene un determinado sentido de giro (horario o antihorario)
- Tiene una frecuencia angular= velocidad de giro
2. Fase
- POSICIÓN en la que se encuentra con respecto al ángulo del vector.
- Tener en cuenta: dos protones pueden tener la misma frecuencia pero distinta fase (es decir, uno adelantado respecto al otro).
3. Nutación
- Movimiento oscilatorio del vector de magnetización inducido por un pulso de RF.
- Esto se debe a que pulso de RF aplicado perpendicular a B₀ proporciona además un campo B₁
Resultado: el vector se inclina desde el eje longitudinal (Z) hacia el plano transversal (XY). El ángulo de inclinación se llama ángulo de flip (flip angle).
** Los que se orientan en sentido antiparalelo se encuentran en un estado de energía mayor.
** De forma natural hay una mayor cantidad de protones que orienten de forma paralela en cuanto al campo magnetico que de forma antiparalela**.
** Los protones no se encuentran quietos, "mirando " en sentido del campo magnetico o en sentido inverso, si no que se encuentran girando sobre sí mismos, describiendo un giro circular, denominado precesión.
** La orientación de giro que tienen se llama spin y habitualmente es representado con un vector.
** La suma de los diferentes vectores-espines de una sustancia proporciona un vector único que provoca una magnetización neta resultado de dicha suma total.
2. APLICACIÓN DEL CAMPO MAGNÉTICO: PRODUCE LA PRECESIÓN de los protones
Precesión: MOVIMIENTO COMPUESTO DE DOS EJES: ROTACIÓN CON UN ÁNGULO SOBRE SI MISMOS Y ALREDEDOR DEL CAMPO MAGNÉTICO
¿QUÉ VARÍA EN EL PROTÓN EL CAMPO MAGNÉTICO B0?
- Induce la precesión del momento magnético a una frecuencia angular definida. Según fórmula de Frecuencia de Larmor (PRECESIÓN)
- Determina el sentido (en el caso del protón, antihorario desde arriba) (ALINEACIÓN). El CM funciona como un gran imán que orienta los diferentes espines de las diferentes sustancias en paralelo o antiparalelo al sentido de la fuerza magnética aplicada.
Al aplicar el Campo Magnético podemos decir que ahora los protones están RESONANDO (a una frecuencia determinada)
El vector conformado por todos los protones, una vez aplicado el campo magnético, será de orientación paralela o antiparalela, girando entorno a este formando un pequeño ángulo.
Dicho vector general longitudinal (vector de magnetización=M) no se puede medir, ya que está en la misma dirección del campo magnético empleado.
Tener en cuenta que el Campo Magnético no deja de aplicarse durante toda la adquisición del estudio.
3. APLICACIÓN DEL PULSO DE RADIOFRECUENCIA (LA ANTENA QUE PRODUCE EL RUÍDO QUE SE GENERA EN LA PRUEBA Y QUE REQUIERE EN ALGUNOS CASOS DE PROTECCIÓN AUDITIVA):
¿QUÉ VARÍA EN EL PROTÓN EL PULSO DE RADIOFRECUENCIA ?
El objetivo primordial es pertubar a estos protones, que se encuentran alineados con el campo magnetico externo y que no se pueden "medir".
Primero tenemos que tener en cuenta, que para poder modificarlos, el pulso de radio emitido debe poder intercambiar energía con los mismo y para ello debe tener la misma frecuencia-velocidad que los protones, es decir LA MISMA RESONANCIA (motivo por el que se llama así a la prueba).
- El pulso RF inclina el vector de magnetización (ej.: 90° o 180°) (flip angle).
- Además, sincroniza a los protones en fase → generando así una señal coherente detectable (eco). Este proceso por el que los protones se encuentran girando de forma sincronizada, alineados y transversales al campo magnético se denomina "EN FASE". Han adquirido una magnetización transversal.
Una vez transmitido un pulso de radiofrecuencia determinado que se les ha proporcionado energía a algunos protones, de algunas sustancias, pasan a encontrarse en sentido antiparalelo, que era un estado de mayor energía.
A mayor intensidad del pulso de radiofrecuencia, más se alejará el vector de giro del eje del CM BO (mayor flip angle–mayor magnetización–mayor magnetización transversal Mxy). Cabe decir que la inclinación de dicho vector de giro además de producirse por el pulso de radiofrecuencia, se da de forma natural por las inhomogeneidades del CM, y la interferencia spin-spin entre los diferentes protones.
El pulso de radiofrecuencia es necesario para provocar la EXCITACIÓN (que es lo mismo que decir que se encuentran EN FASE): En este estado: 1. Los protones se encuentran en la misma fase-posición y 2. Tienen la misma velocidad de giro=frecuencia de precesión; debido al campo magnético B0 que sigue actuando).
Esta excitación es un estado de alta energía. Tras el cese del pulso de radiofrecuencia y por tanto de la excitación se produce la emisión de energía, en forma de onda, que va a ser captada por la bobina (comúnmente conocida como antena).
4. CESE DEL PULSO DE RADIOFRECUENCIA:
¿QUÉ PASA CUANDO SE DEJA DE APLICAR EL PULSO DE RADIOFRECUENCIA?
Se produce la relajación:
- T1 (longitudinal): recuperación del magnetismo en Z (recuperación del ángulo con respecto al B0 inicial) (se reduce el flip angle). El tiempo que tarda el sistema en alcanzar su magnetización longitudinal al 63% original, tras el cese del pulso de radiofrecuencia, se denomina T1 o TIEMPO DE RELAJACIÓN LONGITUDINAL. El T1 depende más de la cantidad de protones de las sustancias.
- T2 (transversal): pérdida de coherencia de fase en XY (los protones) (se desfasan). El tiempo que tarda el sistema en alcanzar su magnetización transversal al 37% original, tras el cese del pulso de radiofrecuencia, se denomina T2 o TIEMPO DE RELAJACIÓN TRANSVERSAL. El T2 de la relación de las sustancias con el campo magnético y las dishomogeneidades
¡¡ Los protones recuperan antes el T2 original (que sigue estando sometido al CM B0), que el T1 (la inclinación del eje del vector de giro con respecto al CM B0)!! Es decir, se desfasan más rápido de lo que reducen su flip angle.
EXPLICACIÓN DE LOS GRADIENTES Y DE SU FUNCIÓN:
Si la excitación de todos los espines se realizara al mismo tiempo no se podría saber de donde viene la señal de los tejidos.
Los gradientes de codificación son todos ellos campos magnéticos adicionales al CM B0 que impera durante todo el tiempo en que se desarrolla nuestro estudio. Cada uno de estos gradientes tiene una función principal que se detallará a continuación, pero de forma básica, lo que pretenden es que el pulso de radiofrecuencia consiga estimular la región de interés (ya que para ser estimulada necesita de resonar a una frecuencia determinada), así como codificar la onda magnética obtenida de la zona de interés en términos de función de fase y frecuencia.
La señal registrada es una onda compuesta, formada por la superposición de múltiples señales con distintas frecuencias y fases, correspondientes a diferentes posiciones del tejido. Esta señal se organiza en el denominado espacio k mediante la transformada de Fourier, que traduce la información de frecuencia y fase en una estructura espacial. Finalmente, una transformada de Fourier inversa del espacio k permite reconstruir una imagen codificada en términos de frecuencia y de fase en términos de posición e intensidad de señal.
Vamos a ir detallando a continuación:
1. Gradiente de selección de corte:
¿Cuándo se aplica?
→ Durante el pulso de radiofrecuencia (RF).
¿En qué dirección?
→ En el eje perpendicular al plano que queremos adquirir (por ejemplo, eje Z si queremos una imagen axial).
¿Para qué sirve?
→ Selecciona un plano específico del cuerpo (un “corte” o “slice”) donde se va a excitar a los protones
¿Cómo lo consigue?
- Se aplica un gradiente en el eje Z, de modo que el campo magnético varía linealmente en ese eje.
- Como la frecuencia de resonancia depende del campo magnético, los protones a diferentes alturas (Z) precesarán a diferentes frecuencias.
- Se emite un pulso de RF centrado en una frecuencia específica: solo los protones que estén en el plano donde el campo local coincide con esa frecuencia absorben energía y se excitan.
- El grosor del corte depende del ancho de banda del pulso de RF y de la intensidad del gradiente.
2. Gradiente de codificación de fase (Phase Encoding Gradient)
¿Cuándo se aplica?
→ Justo después del pulso de RF y antes de adquirir la señal.
¿En qué dirección?
→ En el eje Y (en una imagen axial típica).
¿Para qué sirve?
→ Codifica la POSICIÓN de los protones a lo largo del eje Y mediante diferencias de fase.
¿Cómo funciona?
- Se aplica un breve gradiente en el eje Y.
- Los protones en diferentes posiciones a lo largo de ese eje precesan a velocidades ligeramente diferentes durante el tiempo que está activo el gradiente → se acumula una diferencia de fase entre ellos.
- Al desactivar el gradiente, todos vuelven a precesar a la misma frecuencia, pero las diferencias de fase permanecen.
- En cada repetición del pulso (TR), se varía la intensidad de este gradiente para recorrer todas las líneas del espacio K (dominio de Fourier).
3. Gradiente de codificación de frecuencia (Frequency Encoding Gradient)
¿Cuándo se aplica?
→ Durante la lectura de la señal (lectura del eco).
¿En qué dirección?
→ En el eje X (en una imagen axial típica).
¿Para qué sirve?
→ Codifica la posición de los protones a lo largo del eje X mediante diferencias de frecuencia.
¿Cómo funciona?
-
Mientras se recoge la señal (eco de spin o eco de gradiente), se aplica un gradiente en X.
-
Esto hace que los protones a lo largo de ese eje precesen a frecuencias distintas: cada posición X se asocia con una frecuencia diferente.
-
La señal resultante contiene un conjunto de frecuencias que el sistema de reconstrucción puede convertir en una imagen.
Al final de este proceso tenemos que los protones del corte seleccionado van a precesar a una velocidad diferente con respecto al resto del cuerpo y que además van a tener una fase diferente y una precesión diferente entre ello en los ejes X e Y antes de proceder a la lectura.
Al final de este proceso; de aplicar el pulso de radiofrecuencia y los 3 gradientes tenemos que:
- Cada punto anatómico del corte excitado, tras la aplicación de los gradientes de codificación de fase y frecuencia, adquiere una frecuencia y fase únicas que lo distinguen del resto.
Pero por ahora… nuestras bobinas no son capaces de detectar la señal de cada punto anatómico individualmente. De esta forma la bobina va a captar todas las señales emitidas simultáneamente por todos los protones del corte y ésta señal, compuesta por múltiples ondas de distintas frecuencias y fases se organizarán el espacio K. Gracias a la transformada de Fourier inversa que nos permitirá saber la contribución de cada punto de tejido en base a su frecuencia y fases características y permitiendo así reconstruir la imagen anatómica en términos de posición e intensidad.
Vamos a ir desglosando:
4. RECOGIDA DE ENERGÍA Y VISUALIZACIÓN EN EL ORDENADOR:
Cada sustancia, al tener diferente densidad protónica va a tener diferente T1 y T2 y va a emitir diferente cantidad de energía por tanto, una vez cesado el pulso de radiofrecuencia. Ejemplo: el agua tiene un T1 muy largo y un T2 largo. La grasa por el contrario tiene un T1 corto.
Cuando adquirimos las imágenes potenciadas en T1 "hacemos hincapié" EN EL TIEMPO DE RELAJACIÓN LONGITUDINAL DE LAS SUSTANCIAS. De esta forma las sustancias con un T1 (como los líquidos) se representarán como zona oscura en el ordenador. La grasa tiene un T1 corto (se ve hiperintenso).
¿CÓMO SE GENERA EL ESPACIO K?
- ¿Por qué se llama k?: Se ha utilizado este término durante más de un siglo en los campos de la óptica, la acústica, la mecánica y el electromagnetismo para referirse a la frecuencia espacial de las ondas en diversos medios.
- ¿Qué es una frecuencia espacial?
La frecuencia espacial mide cuán rápido cambian los valores de señal en el espacio; ¡Es decir, cómo varía la función de onda a lo largo del eje x (frecuencia) o y (fase)!. Ese eje x e y viene determinado por los gradientes de frecuencia
- ¿Cada píxel (muestra) de una línea del espacio-k que se adquiere tras un pulso de RF corresponde a un grupo de protones con fase y frecuencia (precesión) diferentes?
No, como hemos comentado anteriormente, el espacio K no determina posición espacial. Tampoco cada línea del espacio k coincide directamente con una línea del corte anatómico analizado.
Cada punto del espacio k contiene información de todo el corte. Esto es así porque en realidad cada punto nos muestra las características de la onda obtenida de todo el corte a una determinada frecuencia y fase.
Tenemos que tener en cuenta que una vez cesa el pulso de radiofrecuencia, la bobina receptora capta una señal en forma de onda de TODO el corte. La señal de esta onda que capta es en básicamente en forma de frecuencia de precesión y de fase y según sus valores se dispondrá en el espacio K (que es un mapa cartesiano)
- Estas ondas planas tienen frecuencia espacial (cuán finos o gruesos son los detalles), fase (desplazamiento del patrón), amplitud (intensidad de la variación) y dirección.
Esta señal no se organiza inicialmente en función de la posición anatómica, sino que se dispone en el llamado espacio k, que representa la información en términos de variaciones de frecuencia y fase de la señal, en diferentes direcciones del espacio.
En otras palabras, la señal recogida refleja cómo cambia la intensidad de la imagen en el espacio, y no directamente dónde están las estructuras (es decir, no nos dicen dónde están las estructuras en la imagen, sino qué tan frecuentemente varían los detalles en cada dirección).
En el espacio k:
- kₓ: eje horizontal → Frecuencia espacial en x: variación en la frecuencia de onda→ se codifica con el gradiente de lectura
- kᵧ: eje vertical → Frecuencia espacial en y: variación en la fase de onda→ se codifica con el gradiente de fase.
COMO SI EXISTE UNA RELACIÓN ENTRE: VARIACIÓN DE FRECUENCIA CON RESPECTO AL TIEMPO y LA POSICIÓN ANATÓMICA Solo tras aplicar una transformada de Fourier sobre los datos del espacio k (en donde se pondera la influencia de todos los puntos sobre los mismo ) se obtiene una imagen codificada en términos de posición e intensidad.
¿Entonces qué información contiene exactamente un punto del espacio k?
La RM no almacena solo intensidades reales, sino los valores fundamentales de una onda; valores complejos (reales + imaginarios). Cada punto del espacio-k contiene un número complejo, no un número real.
Número imaginario: Número real por la unidad imaginaria (raíz cuadrada de -1)”Este número no puede ser representado en la línea recta (de ahí lo de imaginario).
- Una frecuencia espacial definida → su "tamaño de detalle", determinada por la distancia al centro (0,0). Su módulo (longitud del vector) nos dice cuán alta o baja es la frecuencia espacial.
- Una orientación → hacia dónde apunta esa onda, determinada por la dirección del vector (kₓ, kᵧ).
- Una fase → codificada en la parte compleja del valor almacenado en ese punto.
- Una amplitud → codificada en la magnitud (valor absoluto) del número complejo en ese punto.
Variaciones del proceso anterior según del tipo de secuencia que se haga
¿Cuántos pulsos de radiofrecuencia se aplican en una sola imagen 2D?
Se aplica un pulso de RF por cada línea del espacio K que se quiere llenar. Y el número de líneas del espacio K equivale normalmente al número de píxeles en la dirección de codificación de fase (eje Y). Por ejemplo: si quieres una imagen de: 256 x 256 píxeles. Entonces necesitas 256 pulsos de RF. Se aplica un gradiente de corte, fase y de frecuencia por cada corte.
¿Y si es una imagen 3D?
Se aplica un solo pulso de RF para excitar todo el volumen. SE CARECE DEL GRADIENTE DE CODIFICACIÓN DE CORTE.
Por el contrario se necesitan dos gradientes de fase: Uno en eje Y (como en 2D), Otro en eje Z (para separar los diferentes cortes dentro del volumen).
Posteriormente se aplica el gradiente de codificación de frecuencia.
-----------------------------------------------
¿PERO Y QUÉ PASA SI APLICAMOS MÁS DE UN PULSO DE ENERGÍA?:
- Tiempo de eco (TE): es el tiempo transcurrido entre el primer pulso enviado y la recogida de señal.
-Tiempo de repetición (TR): es el tiempo que pasa entre un pulso de excitación y el siguiente, es decir, el tiempo que tardamos en volver a repetir el ciclo de la secuencia.
-Tiempo de adquisición (TA): es el tiempo necesario para obtener la imagen, desde que emitimos el primer pulso hasta que obtenemos la imagen final. Es el tiempo dedicado al estudio. Depende también del procesado por ordenador y otros factores.
Esta nueva emisión la realizaremos en un tiempo T=TE/2, en el que los núcleos se relajan. Tras él, esperamos un nuevo T y recogemos la señal que en este caso se conoce como señal eco y por tanto como spin-eco.
¿POR QUÉ EN LA SECUENCIA SPIN-ECHO TR largo y TE largo provoca que obtengas una imagen potenciada en T2 y viceversa una en T1??:
En principio podría ser contradictorio porque la magnetización transversal se pierde antes y por tanto la señal T2. Entonces ¿Cómo puede ser que al aplicar un TR largo obtengamos señales potenciadas en T2?. Esto se debe a que con un TR largo te aseguras que la magnetización longitudinal, que tarda más en desaparecer, lo haga. Por otra parte, al aplicar un nuevo pulso de radiofrecuencia una vez agotada la magnetización longitudinal ya solo nos quedará la magentización transversal dándonos señal.
Por tanto TR corto (de 3 dígitos) genera imagen potenciada en T1 mientras que una TR largo (4 dígitos) genera imagen potenciada en T2.
Un TR corto (de 3 dígitos) genera imagen potenciada en T1 mientras que una TR largo (4 dígitos) genera imagen potenciada en T2.
Las secuencias en densidad protónica tienen un TR mayor de 2000, similares a lasT2 mientras que tienen un TE pequeño y esto es similar al T1. Buena delimitación anatómica y líquido lo vemos hiperintenso. Secuencia ampliamente utilizada en músculo.
La grasa tiene un T1 corto y un T2 corto: En imágenes potenciadas en T1 la grasa es hiperintensa. El agua un T1 largo y un T2 largo.
¿Cómo medimos las inhomogeneidades del campo magénetico (interferencias)?
El es el T2*: consiste en la medición justo después de aplicar un primer de RF, justo antes de que empieze el desfase (el propio T2).
De forma general nos quedaremos con los siguientes aspectos y es que:
- Un TR largo proporciona señales similares de los tejidos mientras que un TR corto proporciona una mejor diferenciación mejor entre ellos.
- TR largo y TE largo implica una imagen potenciada en T2 = LA IMAGEN SE OBTIENE TENIENDO EN CUENTA SOBRE TODO LA COHERENCIA DE FASE DE LOS PROTONES.
- TR corto y TE corto implica una imagen potenciada en T1= LA IMAGEN SE BASA SEGÚN LA VERTICALZACIÓN DE LOS PROTONES.
- TR corto y TE largo implica ausencia de señal.
- TR largo y TE corto implica una imagen potenciada en densidad protónica.
***** TR : CORTO < de 500 mseg. LARGO > de 1500 mseg.
¿Cuándo se considera un TR corto? ¿Y un TE largo? Si bien los valores son aproximados, se pueden utilizar los siguientes:
• TR corto: <700-800 ms.
• TR largo: >1500-2000 ms.
• TE corto: <20 ms.
• TE largo: >80 ms.
Ejemplo: Si tenemos dos tejidos con tiempos de relajación diferentes, si empleamos un pulso de 90 grados tenemos una fuerte magnetización transversal y baja longitudinal. Si esperamos un TR largo antes de emitir un nuevo pulso ambos tejidos alcanzarán nuevamente sus valores estándares y no se podrá diferenciar. En cambio, si empleamos un TR corto, al tener tiempos de relajación diferentes, con la emisión de un nuevo pulso el tejido que se relajaba rápido va a presentar una nueva magnetización transversal mucho más fuerte y generará una señal mas fuerte que el que se relajaba mas lentamente una vez que se le aplique el nuevo pulso.
DEBIDO A ESTO UN TR CORTO SERA BUENO Y UTIL PARA DIFERENCIAR TEJIDOS SI NOS FIJAMOS EN T1. ES DECIR, OBTENDREMOS UNA IMAGEN POTENCIADA EN T1. POR EL CONTRARIO UN TR LARGO SE UTILIZARÁ PARA IMÁGENES POTENCIADAS EN T2.
Imagen potenciada en T1: TR corto y TE corto.
------------------------------------------------
FAMILIAS DE SECUENCIAS:
¿QUÉ DIFERENCIAS GENERALES HAY ENTRE UNA SECUENCIA SPIN-ECHO CLÁSICA Y UN TURBO SPIN-ECHO=FAST SPIN ECHO (según fabricante)?
Nombres de secuencia rápidas de spin echo: Turbo Spin echo (Philips, Siemens), Fast Spin Echo (GE), RARE (nombre original) ;
Antes de nada debemos de mencionar que al proceso anteriormente comentado en una secuencia Spin Echo clásica (campo magnético, pulso de radiofrecuencia de 90 º, gradientes de codificación) debemos de adicionar un nuevo paso. La administración de un pulso de 180º. Esto se hace principalmente para reducir inhomogeneidades del sistema y reorientar los spines desfasados.
- Se administra tras aplicar el pulso de 90º y a mitad del TE.
- Corrige el desfase producido por las inhomogeneidades del sistema, no por la aplicación de los gradientes, que se administran después y producen un desfase controlado y deliberado. Lo consigue porque al invertir el orden, los protones que giran más rápido “se colocan” detrás de los que giran más lento y los “pillan” de nuevo, encontrándose en fase de nuevo.
En una secuencia Spin-Echo:
En cambio, en una secuencia Spin-Echo turbo se aplica una SERIE DE PULSOS de 180° (en vez de uno por línea) tras un único pulso de 90°, para rellenar varias líneas del espacio-k (ETL Líneas). Para rellenar cada una de las líneas se ha tenido que aplicar un nuevo valor del gradiente de codificación de fase (Gy) → selecciona una nueva línea del espacio-k en dirección kᵧ.
Ejemplo: Si tenemos una secuencia turbo Spin-Echo que codifica 8 líneas del espacio K
¿Cuántos pulsos de radiofrecuencia y gradientes utilizaremos?
- ¿Cómo se adiciona una supresión grasa o líquido a la secuencia base SPIN ECHO?
Podemos emplear pulsos específicos de saturación (satura específicamente dicha sustancia) o mediante técnicas de inversión recuperación (anula previamente todos los tejidos. Posteriormente se envía un pulso de excitación en el momento en el que el tejido de interés no puede ser excitado)
Se añaden pulsos de saturación específicos antes del pulso de 90° principal de la secuencia (secuencias SPIR, SPAIR). Estas técnicas modifican el estado inicial de los tejidos antes de la adquisición.
Estos pulsos se adicionan para estimular el tejido que queremos suprimir antes del pulso principal de tal forma que cuando aplicamos el pulso de 90º en vez de estimular a dicho tejido lo suprime.
En el caso de pulsos de inversión y recuperación (FLAIR, STIR). Por ejemplo en el caso de la secuencia FLAIR el pulso de radiofrecuencia que se aplica antes del principal es de 180º. De esta forma todos los tejidos están invertidos. Cuando el líquido cefalorraquídeo pasa por 0º entonces se adiciona el de 90º. De esta forma se estimularán todos los tejidos a excepción del LCR.
- Aumentan el tiempo de exploración.
- Algunos ejemplos son: STIR (anula grasa): 180º (esto permite que a medida que se vuelven a verticalizar hay un momento que pasan por la "línea" de la sustancia que queremos anular y es ahí donde recibir su señal para anularlo)-90º-180º. ANULA TODAS AQUELLAS SUSTANCIAS CON T1 LARGO; HACE BRILLAR LO PATOLÓGICO (EL AGUA/EDEMA). ¡Cuidado con el contraste , que acorta el T1 de todos los tejidos!.
- FLAIR (anula LCR): Elimina la señal de los líquidos libres (incluyendo el LCR) y aumenta el contraste con las zonas adyacentes. Normalmente se aplica sobre un Espin-Echo turbo. Tener en cuenta que como no tiene sensibilidad a la susceptibilidad y por tanto no detecta muy bien la hermorragia.
- En otros casos podemos aplicar pulsos específicos de excitación de una determinada sustancia para saturarlas antes de empezar con cualquier tipo de secuencia. Es por ejemplo, FAT WATER (anula agua).
¿QUÉ DIFERENCIAS GENERALES HAY ENTRE UNA SECUENCIA SPIN-ECHO CLÁSICA Y UN ECOGRADIENTE?
En una secuencia Spin-Echo antes de aplicar los gradientes de codificación se aplica un pulso adicional de 180ª para reducir inhomogeneidades. Este pulso de radiofrecuencia adicional se aplica con un TE/2. Reduce al máximo T2* y mantiene a todos los protones en fase entonces es ideal para secuencias potenciadas en T2, ya que además, como la señal T2 requiere poco TE y de TR no retrasa ya de por sí un tipo de secuencia que es más lenta que un ecogradiente.
Por el contrario, la secuencia ecogradiente se basa en la utilización de pulsos de radiofrecuencia en tren menores de 90 º. Inmediatamente después de cada pulso de RF se genera un FID ("Free Induction Decay"). También se produce un Eco de Spin (SE) por cada par de pulsos de radiofrecuencia.
A continuación en la secuencia ecogradiente se van a utilizar gradientes de desfase y refase para controlar ésta señal FID y el ECO spin. Según estos gradientes se utilicen para mantener alta la FID o el Eco de Spin o combinadas tenemos diferentes grupos de secuencias. De este modo tenemos GRE coherentes (buscan preservar la coherencia de la magnetización transversal) o las secuencias GRE dañadas (Spoiled)
- GRE coherentes: Conservan la magnetización transversal de pulso a pulso, aprovechando la coherencia de fase para maximizar el SNR y permitir contrastes complejos. Se estructuran los gradientes de manera que se minimice el "desfase" neto acumulado de los espines entre pulsos. Los pulsos de RF se combinan con gradientes de refase que mantienen la relación de fase entre los espines. Esto permite que la señal de cada pulso contribuya de forma constructiva al estado estacionario de la magnetización. Podemos obtener señal T2/T1. Ej: SSFP como True FISP o Balanced FFE). FIESTA (Fast imaging employing steady-state; secuencia potenciada en T2 que por sus características genera un marcado efecto mielográfico al mostrar un mayor contraste entre el líquido cefaloraquídeo, el estuche raquídeo y su contenido, aportando un gran detalle anatómico en este aspecto) o BALANCE. Proporcionan hiperintensidad a grasas y líquidos. BALANCE, FIESTA y DRIVE son secuencias ecogradiente T2 de alta resolución, pero no producen exactamente la misma señal. El BALANCE, por ejemplo, suele producir más artefacto por movimiento. Estas secuencias en conjunto conforman una subfamilia dentro de la familia ecogradiente: Las secuencia de estado estacionario. En estas secuencias se aplican campos magnéticos y pulsos de radiofrecuencia con TR muy cortos de manera continua y equilibrada en todas las direcciones, para evitar exclusivamente que no decaiga la magnetización transversal, amplificando así la señal de los tejidos con altos tiempos de relación T2/T1. Tienen TE y TR cortos pero dan una señal que resalta los líquidos porque permiten reducir la caída de señal de exlusivamente la magnetización transversal. Limitaciones: Muy sensible a las inhomogeneidades del campo magnético al utilizar TE muy cortos.
- GRE incoherentes, dañadas (Spoiled): En las secuencias incoherentes se “destruye” intencionadamente la magnetización transversal residual entre pulsos. Se emplean gradientes y/o pulsos de RF con fases variables (técnicas de spoiling) que destruyen a propósito la magnetización transversal residual que ya de por sí estaba altamente influenciada por el efecto T2* no corregido por la ausencia del pulso de 180º. Cada pulso de excitación se basa únicamente en la magnetización longitudinal recién recuperada. PERMITE OBTENER IMÁGENES POTENCIADAS EN T1 O T2*. Ej: SPGR o FLASH.
- Fase y Fuera de fase (Desplazamiento químico- DIXON):Detecta vóxeles con mezcla de grasa y agua. Si cae de señal en fase opuesta quiere decir que contiene una mezcla de grasa y agua (ejemplo en metástasis vs adenoma). Si por el contrario la estructura solo contiene grasa entonces no habrá decaimiento de fase. No debe administrarse con contraste iv ya que la captación de la lesión puede no evidenciarse o incluso puede producirse un incremento paradójico de la supresión grasa. ¡¡ Cuando decimos que nos encontramos en fase quiere decir que sumamos tanto la intensidad del agua y grasa dando como lugar una señal en T1 más alta, y se restan cuando se encuentran en fuera de fase!!* Importante tener en cuenta que no suprime la grasa madura=macrocópica (Para ello necesitaríamos una secuencia específica de supresión grasa).
A la secuencia ecogradiente podríamos decir “no le importa” que los protones se desfasen (decay T2) debido a la influencia de las inhomogeneidades del CM (no aplica pulso de 180º) (aunque se puede reducir el decay T2 como por ejemplo se hace en las secuencias de coherencia de fase). Por tanto y de forma general podemos decir que este tipo de secuencia va obtener imágenes potenciadas en T1 y T2*. Por el contrario lo que sí hace es aplicar gradientes inversos en varias ocasiones, lo que permite mantener la horizontalidad del vector de giro constante para que no pierda energía.
Tanto el gradiente de refase en ecogradiente como el pulso de 180º en spin echo se utilizan con el fin de maximizar la coherencia de la señal, poniéndola en fase en el momento del eco, pero en la secuencia spin-echo se hace mediante un pulso de radiofrecuencia y en la secuencia ecogradiente mediante campos magnéticos.
En el caso de la secuencia ecogradiente tenemos varias diferencias. Estas diferencias en orden cronológico son:
- Pulso de radiofrecuencia <90º.
- No se aplica pulso de 180º para reducir las inhomogeneidades.
- Se desfasan todavía más a los protones aplicando un gradiente de desfase controlado, lo que aumenta y disminuye la velocidad de precesión de los protones a lo largo del eje. Posteriormente aplica el gradiente de refase en el mismo eje X pero invertido, que va a refasar sólo los spines que han sido desfasados por la acción del gradiente de desfase (no los desfasados por las inhomogeneidades del campo) → se forma un eco de gradiente, no de spin. Por eso se puede usar un pulso de RF más corto (incluso < 90°), lo que permite reducción de SAR (absorción de energía) y TR más corto.
- Tienen por tanto también menor TE y TR.
En SE, el eco se produce por inversión de la fase con el pulso de 180°. En GRE, se invierte el gradiente de lectura para re-focalizar la señal → más rápido, pero más sensible al campo.
Esto provoca que las secuencias ecogradientes sean:
- Más susceptibles a artefactos (tanto por movimiento como por inhomogeneidades). La secuencia de SWI y difusión tienen su origen en esta familia de secuencia.
- Más rápidas: Por utilizar únicamente un pulso de radiofrecuencia menor de 90º (que a provoca que el TE y el TR sean más cortos). Los vasos y su contenido vascular aparece con señal.
- Más fácil de obtener secuencias volumétricas o de alta resolución. En cuanto a las secuencias volumétricas esto es debido a que la secuencia spin echo necesitaría muchos pulsos de 180º y por tanto sobrecalienta y el tiempo es más largo porque se adquieren en bloques las líneas del espacio K.
Otras secuencias y aspectos:
- Secuencias tof: Time of flight : no utilizan contraste pero permiten reconstruir vasos arteriales y venosos. Se basa en secuencias rápidas ecogradientes. "La llegada de nueva señal a la máquina de RM permite proporcionar una hiperintensidad".
Tof y ASL siguen procedimientos relaticamente similares, pero el tof se utiliza para estudios vasculares y el ASL para estudios de perfusión. El tof se vasa en la diferencia de magnetizacion entre el tejido estacionario y la sangre en movimiento. El ASL hace marcaje de hematies previamente y luego analiza los que entran, salen etc de los vasos para realizar cálculos de perfusión. El tof hace una diferencia entre la materia estacionaria y el movimiento de los protones que entran en ese marco de materia estacionada previamente marcada.
* CUIDADO CON LOS TROMBOS: UTILIZAR ASL; angiografía de contaste de fase. En el tof el trombo aparece brillante, al igual que el flujo porque es secuencia T1.
* ANGIO 3TOF: Combina tof con contraste.
- Técnicas T2 mapping Su utilidad es detectar anomalías del cartílago articular basadas en cambios en los tiempos de relajación, especialmente T2, no identificables con las secuencias convencionales. El tiempo de relajación T2 se dilata en las primeras fases de daño del cartílago, al aumentar su contenido acuoso en las capas más profundas, sustituyendo a los proteoglicanos. Las secuencias típicas de T2 mapping presentan un grosor del corte fino del orden de 2-3 mm, obtenidos perpendicularmente a la superficie del cartílago. Se obtienen de cuatro a seis ecos, con TE de 5 a 100 ms y TR y demás parámetros constantes. Estos pueden ser ecos de espín (para estimar T2) o ecos de gradiente para estimar T2*. Tras calcular los tiempos de relajación, se crean mapas codificados de colores para permitir identificar cambios dentro del cartílago.
- Secuencias de excitación del agua (WE): Se basa, al igual que la FAT-SAT en pulsos de saturación selectivos. En la secuencia WE se excitan selectivamente los protones del agua y dejan los de la grasa sin excitar. Se trata de un tipo de saturación grasa menos sensible a campos magnéticos inhomogéneos, aunque no exenta de artefactos, y más rápida que la FATSAT. En S-MSK es útil para valoración del cartílago debido al contraste que genera sobre la señal anulada de la grasa, con posibilidad de cortes finos de forma rápida.
- Física de la T2*: El tiempo de relajación T2* (leído como estrella T2) es una medida de relajación transversal que abarca tanto los efectos intrínsecos de T2 como el desfase adicional resultante de las faltas de homogeneidad en el campo magnético. Estas faltas de homogeneidad pueden ser derivadas de las características del tejido o derivadas de imperfecciones en el campo magnético de la máquina de RM. En condiciones IDEALES T2=T2*.
Los efectos de T2* se observan con mayor frecuencia en las imágenes GRE, donde la señal de RM se desvanece más rápidamente que con la caída de T2 sola. Como resultado, la mayoría de las secuencias T2* son secuencias GRE. Se utiliza tanto para la secuencia de susceptibilidad como para la fMRI--> detectar la actividad cerebral midiendo los cambios en el flujo sanguíneo cerebral donde las regiones activas del cerebro muestran cambios en el equilibrio de oxihemoglobina a desoxihemoglobina y lo que influye en los valores de T2*.
- Secuencia de susceptibilidad magnética:
Fundamentos de la SWI (susceptibility weighted imaging)
Como comentamos anteriormente en la resonancia magnética, cada espín precesa alrededor del campo magnético principal (B₀) y su señal se puede describir como una onda compleja, con dos componentes:
- Magnitud → La intensidad de la señal (lo que se suele usar en la mayoría de las imágenes).
- Fase → El ángulo (en radianes o grados) que describe el desfase entre espines respecto de un eje de referencia (generalmente el eje real).
SWI es la combinación de una secuencia específica y un diseño de procesamiento desarrollado para realzar el contraste en imágenes ponderadas en T2*. Para ello no se centra (que también lo tiene en cuenta pero en menor grado) en medir la magnitud de la señal (la fuerza o intensidad del eco) sino que mide la señal de pérdida de la fase de los protones; conocido como decay T2 (debido a fenómenos de susceptibilidad o inhomogeneidades del campo) en términos de angulación de la fase protónica. Para ello emplea TE relativamente largos. A mayor TE más sensibilidad a la susceptibilidad pero más ruido.
Por tanto, la principal diferencia entre SWI y T2* es que SWI mide, a parte del decay T2, el valor angular de la fase tras el proceso de desfase protónica
La SWI pretende aislar este fenómeno de susceptibilidad. Para ello realiza el siguiente procedimiento:
- Filtrado de fase: elimina (filtra) aquellos “artefactos” atribuibles a inhomogeneidad del campo magnético que provocan el decay T2 (lógicamente no elimina el fenómeno de susceptibilidad que es lo que se quiere medir). Para ello elimina las variaciones lentas en la fase y deja solamente las fluctuantes relevantes y propias de la susceptibilidad. Para su realización normalmente emplea un tipo de filtro de alta frecuencia tipo homodyne o filtro de laplaciano.
- Generación de máscara: Resaltación de zonas con diferencia de susceptibilidad notable (normalmente emplea una transformación del tipo sigmoidal o lineal invertida).
- Combinación con la imagen de magnitud: Se combina filtrado de fase con la máscara para una mejor visualización de la imagen y las estructuras. Al combinarla con la imagen de magnitud, se potencia el contraste de estructuras sutiles (normalmente se multiplica la imagen de la magnitud por la máscara de fase)
Posprocesamiento básico en SWI: Lo más importante es la filtración de la fase para resaltar las estructuras paramagnéticas.
- Nota: Anteriormente a la SWI se utilizaba una secuencia ecogradiente T2 (originalmente desarrollada para observar la desoxihemoglobina en venas y microhemorragias), que utiliza un TE corto para sensibilidad el decay T2. Al ser también una secuencia con un ángulo de giro pequeño provoca que la señal venga determinada principalmente por LA DENSIDAD SPIN → buen contraste y baja resolución. Al aumentar el TE por lo general se aumenta sensibilidad a costa de aumentar el ruido en la señal.
- Los objetos que modifican el campo magnético, es decir con elevada susceptibilidad posee un efecto dipolo. Esto se debe a que generan en su entorno una perturbación en el campo magnético, lo que se conoce como efecto dipolar. Ejemplo: Imagen que tiene polo norte y sur. La forma en que se manifiesta este campo dipolar varía según el ángulo relativo al campo principal B0 de la resonancia magnética.
- "Aunque las microcalcificaciones se pueden distinguir de las microhemorragias basándonos en el desplazamiento de fase, si tienen formas geométricas que no son redondas el desplazamiento de fase no es homogéneo y presenta una señal heterogénea. Hace que tanto la sangre como el calcio puedan tener la misma señal dependiendo del ángulo de medición. Esto se debe principalmente a que aunque en principio la microhemorragia (paramagnética) y el calcio (diamagnética) provocan desplazamientos de fase opuesta. Al depender del ángulo de medición la señal puede llegar a considerarse la opuesta. Por ejemplo: el Ca presentan propiedades diamagnéticas, lo que implica que tienden a repeler el campo magnético → tiende a disminuir el campo local ; al contrario de lo que hace la sangre.
- ¿Por qué en objetos grandes la pérdida de señal se produce en los bordes del objeto?
En objetos grandes, el interior del objeto suele tener un campo magnético relativamente uniforme, lo que permite que los espines mantengan una fase similar y, por lo tanto, se conserve la señal. Sin embargo, en los bordes se produce un cambio brusco en la susceptibilidad magnética debido a la transición entre el tejido y el entorno (por ejemplo, entre tejido y aire o entre dos tipos de tejido). Este cambio genera gradientes locales en el campo magnético que provocan un desfase más pronunciado de los espines en esas zonas, y como consecuencia se cancela la señal.
- ¿Cómo muestran la información de fase los comerciales?
Habitualmente… sistema "zurdo" →fase es positiva en el sentido de las agujas del reloj, sistema "diestro" (la elección habitual) →fase es positiva en sentido antihorario..
- ¿Por qué es importante conocer qué valor asigna el comercial a la orientación de campo magnético?
Porque no existe una fase única espacialmente fuera de un objeto. Tanto las fases dentro como fuera dependen de la geometría. Su medición depende del convenio de RM utilizado
Las diferencias de fase que mide la SWI pueden cambiar su signo (positivo o negativo) dependiendo de la orientación del sistema de RM y de las convenciones adoptadas. Debido a que la señal de fase depende de la dirección de precesión relativa a los gradientes aplicados, el mismo tejido puede mostrar un signo de fase opuesto si el sistema usa una orientación "zurda" o "diestro".
La materia gris es hiperintensa en sistemas zurdos y hipointensa en sistemas diestros.
El QSM es una técnica que modela y corrige estas variaciones de orientación, generando mapas de susceptibilidad cuantitativos que son independientes de la convención utilizada.
Esto elimina la ambigüedad que puede generar la diferencia entre sistemas zurdos y diestros, simplificando la interpretación clínica de las imágenes.
Su explicación conceptual es bastante complicada aunque de forma simple:
- Trabaja sobre la fase filtrada para crear una máscara sin dependencia geométrica. Las venas aparecen resaltadas independientemente de su orientación con respecto al CM.
- Perfusión: Va a medir principalmente "angiogénesis" Angiogénesis "per se" no es definitorio de malignidad.
Utilidad como guía para la biopsia: Las zonas hiperrealzantes en la secuencia T1 postcontraste lo único que van a indicar es la ausencia de BHE sin que esto se corresponda con zona de más agresividad --> Las zonas con mayor VSCr si se correlacionan con áreas de mayor agresividad.
Respuesta al tratamiento: Se produce una disminución del VSCr en la lesión.
Actualmente no existen diferencias significativas en el VSCr entre lesiones gliales y metástasis. NO OBSTANTE EL EDEMA PERILESIONAL EN EL TUMOR GLIAL SUELE SER MÁS HIPERPERFUNDIDO DEBIDO A UNA MAYOR INFILTRACIÓN TUMORAL.
¡¡LA PERFUSIÓN SI DISTINGUE MUY BIEN ENTRE GLIOMA Y ABSCESO!!
¡¡ TAMBIÉN DISTINGUE BIEN ENTRE LESIÓN GLIAL Y LESIÓN TUMEFACTIVA DESMIELINIZANTE!!(MENOR PERFUSIÓN EN LESIÓN TUMEFACTIVA;INCLUSO HIPOPERFUNDIDA)
Tipos perfusion:
1.º T2- basado en ecogradiente T2*; se trata de una secuencia de valoración arterial-capilar-venoso para hacer una valoración de curva de tiempo (puede hacer correciones de saber cuánto pasa a intersticio y anular ésto para estimar mejor la angiogénesis), 2º Basado en secuencia T1; permite valorar también permeabilidad del vaso mediante el cálculo de k-trans (que nos puede indicar que puede haber pocos vasos pero ser de alta malignidad) 3ª Técnicas de arterial Spin Labelling (ASL).
1. T2* (la más utilizada) gracias a la caída de señal que tiene el gadolíneo en secuencias T2* debido a la susceptibilidad. Se suelen utilizar las secuencias ecogradiente por ser más rápidas, con comportamiento lineal a las concentraciones de gadolíneo. Obtenemos las variables: VSC (el más utilizado para neoplasias): se define como el volumen total de sangre que contiene una determinada zona del cerebro, FSC: es definido como el volumen de sangre atravesando una determinada zona cerebral por unidad de tiempo, TTM: representa el tiempo medio que emplea la sangre desde la entrada arterial hasta la salida venosa, medida en segundos. Estos parámetros se relacionan entre sí a través de la fórmula TTM=VSC/FSC. El concepto de relativo (FSCr, VSCr o TTMr) se refiere con respecto al tiempo; el área bajo la curva. Este tipo RM de perfusión SE BASA EN EL SUPUESTO QUE EL CONTRASTE ES PÚRAMENTE INTRAVASCULAR Y NO DIFUNDE AL ESPACIO EXTRAVASCULAR --> SOBREESTIMA EL VALOR VSC
La neoangeogénesis se puede calcular mediante la PRM y el parámetro hemodinámico que debe evaularse para el estudio de tumores es el rVSC. Las regiones con alto rVSC representan zonas de mayor número capilar-->> agresividad. Por otra parte, zonas de alta vascularización no tienen por qué estar asociadas indiscutiblemente con malignidad (ej hememangioblastomas).
Es importante también tener en cuenta que las zonas de mayor perfusión no siempre se correlacionan con las áreas de realce en la imagen por RM en secuencias potenciadas en T1 ya que las zonas de alta captación T1 indican alteración de la permeabildiad de la BHE mientras que nosotros queremos aislar y determinar el concepto de hipervascularización.
El componente sólido de una metástasis y de un glioblastoma poseen valores similares de rVSC ya que la metástasis induce neovascularización similar a glioblastomas. Por otra parte, el edema peritumoral del glioblastoma está también mucho más hiperperfundido que en otros edemas. Esto es debido a la infiltración tumoral.
Tanto en la radionecrosis y la pseudoprogresión lo ideal es que la perfusión no esté aumentada. Valores de rVSC por debajo de 0.6 son sugestivos de radionecrosis.
Se considera que un VSCr de 3 veces por encima con respecto al lado contralateral es prácticamente definitorio de lesión con características de agresividad. Hay varias excepciones a esto. Por ejemplo, el oligodendroglioma, ya que aunque sea de bajo grado se presenta con valores elevados de VSCr.
2. T1: Se puede llegar a utilziar en estuios de base de cráneo donde el uso de T2* con la susceptibilidad se ve influenciado, en el caso de que existe sangrado intralesional o calcifficaciones.
- Difusión: La difusión se basa a diferencia de las técnicas clásicas de RM en el tiempo de relajación, en el movimiento Browniano de las moléculas del agua. Aquellas moléculas que se encuentran en líquido se desfasan (se mueven) de forma aleatoria. Se utilizan secuencias altamente potenciadas en T2 (ecogradiente; ¡cuidado! --> ésto hace que sea una secuencia sensible a la susceptibilidad; la sangre subaguda restringe --> fijarse en secuencia T1 que será hiperintenso ) en las que el valor "b" permite precísamente discernir entre los protones que se mueven y los que no lo hacen mediante la representación de una curva que es el coeficiente de difusión ADC. De esta forma se obtienen habitualmente 2 valores "b" en el que el valor b=0 nos permite saber si lo que vemos hiperintenso en el b alto se debe a efecto T2.
El valor b: refleja la intensidad y el momento de los gradientes utilizados para generar imágenes ponderadas por difusión. Se pueden aplicar dos pulsos de gradiente para que las moleculas de agua pierdan y recuperen la fase. Aquellas moleculas que difundan la distancia maxima no podrán recuperar la fase y perderan la señal. La perdida de señal depende del coeficiente de difusion de la molécula y la intensidad y la duracion de pulso de gradiente.
La tractografía se basa en el principio de la difusión de distinguir el movimiento de los protones. En este caso las moléculas de aguda se desplazan en una misma dirección dentro de las vainas nerviosas.
Por lo general la restriccion de la difusion responde a edema citotoxico ("hinchazón celular"; fallo en la bomba de sodio). No solamente la restriccion de difusion se da en caso de isquemia si no también en estatus de epilepsia y enfermedades autoinmunes. No se sabe fisiopatológicamente exactamente a qué responde la restricción de la difusión ya que en estos ultimos casos mencionados (epilepsia y enfermedades autoinmunes por ejemplo) no se produce muerte celular. La difusión restringida para el infarto dura 7-14 dias.
Se puede obtener con varias técnicas de imagen: ecoplanar, difusión de barrido lineal, difusión ecoespín navegado.
El edema citotóxico es hiperintenso en FLAIR y además RESTRINGE en la difusión. El edema vasogénico no restringe.
Nota: ** El esplenio suele restringir la difusión porque las fibras se disponen anteroposterior y solo pueden movilizarse en dicha orientación.
Mapa ADC (coeficiente de difusión aparente): Valora movimiento del agua. Se aplica sobre secuencias Spin Echo potenciadas en T2. Muy importante para lesiones isquémicas.
- Areas de restricción al movimiento brilla agua y si existen movimiento no habrá resitricción y la señal se verá negro.
- Valoración cualitativa: Proporcionada por los valores individuales de b. El grado de difusión depende del factor b: este factor que determina tanto la secuencia spin echo, como los pulsos de radiofrecuencia emitidos y que determinarán como de potenciada en T2 está la imagen. Hay que tener cuidado para no confundirlo con restricción. El coeficiente de ADC se vera negro.
- Valoración cuantitativa: Lo otorga el mapa ADC Es necesario analizar el mapa ADC (en este caso la restricción en el mapa ADC se ve negra). El mapa ADC nos muestra verdaderamente la restricción, sin que exista contaminación por la señal T2 obtenida. Para ello necesita 2 valores de "b" (uno siempre es 0 y otro menor de 1000 seg/mm2). Uno de los problemas del análisis cuantitativo es que la señal depende tanto de la difusión del agua como del tiempo de relajación T2, de tal forma que lesiones con alto contenido líquido van a poder dar un "EFECTO T2 shine-through (blanco en ADC y blanco en mapa b; te quedas sin saber si restringue o no la difusión)". ESTO lo podemos solucionar mirando el mapa ADC. El mapa B0- es un mapa tipo T2 que te permite saber de base "lo que se mueve y no se mueve".
** La intensidad de la señal que se obtiene no va a depender únicamente del movimiento de las moléculas de agua sino que también varía al modificar la amplitud, duración o intervalo de gradiente aplicado. El parámetro b es proporcional a todos estos actores.
** La restricción de la difusión se verá como un aumento de señal. El aumento de señal presente tanto en el mapa ADC como en la difusión no es una verdadera restricción.
** El valor "b" a medida que aumenta, la intensidad de la señales que proporciona disminuye. De tal forma que valores "b" bajos se utilizan para aumentar la sensibilidad. Esta pérdida de señal será mayor en aquellas lesiones donde la difusión esté facilitada.
RM funcional: Se basa en el efecto T2* de la desoxihemoglobina.
RM espectroscopia:
Se basa en cómo diferente materia absorbe o emite fotonones en diferente cantidad a misma interacción con la misma radición electromagnética.
La energía de un fotón de una onda electromagnética equivale a la frecuencia de nergía entre dos estados cuánticos.
Por tanto el espectómetro es capaz de medir esta energía absorbida o emitida tras la interacción con la radiación electromagnética y asignarle un valor, que va a ser relativamente específico de cada sustancia, en concreto de cada metabolito y más específicamente de su concentración de protones de H, que es el concepto de interés en cuestión en el caso del estudio metabólico de las lesiones. Esta energía emitida también va a depender de la cantidad de los electrones adyacentes=apantallamiento electrónico. Este efecto modifica la frecuencia de resonancia de cada núcleo y permite identificar distintos compuestos químicos.
- Se expresa en partes por millón (ppm), independiente del campo magnético aplicado.
- En un espectro, el cero se establece arbitrariamente en la señal del tetrametilsilano (TMS), compuesto de referencia.
- Cada compuesto químico presenta un desplazamiento característico mayor o menor con respecto a la señal de referencia, lo que permite su identificación.
Se van a utilizar un TE largo (144 ms) o corto (35 ms) (valores variables) para evaluación de diferentes metabolitos. Ejemplo: mionositol en TE corto, Lípidos y lactatos en TE largo.
Generalmente se usan dos secuencias, STEAM (Stimulated Echo Acquisition Mode) y PRESS (Point RESolved Spectroscopy) con previa saturación de agua y grasa mediante técnica Shimming y con pulsos de inversión-recuperación.
TE relación señal/ruído menor y detecta mejor otros metabolitos.
- Creatina y fosfocreatina están relacionados con metabolismo energético (la creatina se encuentra un 20% mayor en la sustancia blanca). Colina relacionado con síntesis de membrana (tener en cuenta su disminución en demencia y enfermedades hepáticas), N-acetilaspartato relacionado con la intregridad neuronal. Analina: Alta concentración en meningiomas Mionositol: Azúcar presente predominantemente en la glía y que se utiliza para la replicación celular. Glutamato: Principal neurotransmisor excitador. Se localiza principalmente en astrocitos. Lactato: en metabolismo anaerobio o en condiciones de replicación celular desmesurado o en abscesos. En condiciones normales su presencia debe ser mínima. Lípidos: Se relaciona principalmente con necrosis. Puede contamianr la señal para la medición de otros metabolitos.
Relaciones más importantes:
Co/NAA: Relación alta en patología tumoral agresiva.
Co/Cre: Relación alta en patología tumoral agresiva.
NAA/Cr: Se relaciona con estados de alta o baja energía. Relación disminuída en esclerosis múltiple o ELA donde en las placas agudas se han apreciado buenos resultados.
NAA/Co:
** Aplicaciones de carácter A: Demostración de utilidad. Patología tumoral, patología metabólica congénita...
** Aplicaciones de carácter B: Ocasionalmente útil en casos individuales. Epilepsia, hipoxia...
** Aplicaciones de carácter C: En investigación. Enfermedades neurodegenerativas...
** Un inconveniente de la aplicación de la espectroscopia a nivel abdominal es la alta presencia de lípidos libres, que va a afectar a la medición de la señal.
------------------------------------------------
¿Cómo detectamos la grasa?: La supresión de grasa se puede lograr con 4 técnicas: saturación espectral de grasa (incluímos aquí la el método de presaturación espectral con recuperación de inversión (SPAIR)), recuperación de inversión de tau corta (STIR), método de Dixon y método de excitación de agua.
- Saturación de la grasa espectral-FAT-SAT-SPIR-SPAIR: Método de inversión recuperación conociendo. Conociendo la precesión exacta de la grasa se administra un pulso de RF para relajarla. Sus ventajas es que anula la grasa de manera muy exacta y se puede utilizar tras la administración de civ. Por otra parte su desventaja es que es sensible a inhomogenidades del campo magnético. ADEMÁS CUANDO COEXISTE GRASA CON AGUA NO SE PRODUCE EL ANULAMIENTO DE SEÑAL.
- Saturación de la grasa inversión recuperación- STIR: Anula la señal de cualquier tejido con tiempo de relajación similar a la grasa --> no diferencia sangre de grasa en ocasiones, no se puede utilizar cuando se administra contraste iv.
- Saturación de la grasa con método DIXON: Se basa en el principio físico del desplazamiento químico (se considera un artefacto de la RM), se permite adicionar a otros tipos de familia de secuencias (por ejemplo, eco de espín, eco de gradiente) y ponderaciones (T1,T2 y Eco-gradiente). La técnica de Dixon aprovecha el hecho de que las moléculas de agua y de grasa preceden a velocidades diferentes. Como tal, con el tiempo, alternarán entre estar en fase y opuesta. La adquisición simultánea de imágenes en fase y en fase opuesta permite que las imágenes se combinen matemáticamente de dos maneras, lo que da como resultado un total de cuatro secuencias. **en fase = (agua + grasa)**fase opuesta = (agua - grasa) **solo grasa = en fase - fase opuesta = (agua + grasa) - (agua - grasa) **solo agua = en fase + fase opuesta = (agua + grasa) + (agua - grasa).
Si añadimos, por ejemplo, una secuencia de saturación espectral de la grasa como SPIR podemos anular tanto la grasa macroscópica como la microscópica.
Aclaración:
SPIR y SPAIR difieren de STIR en varios aspectos:
(1) STIR es una secuencia completa, mientras que SPIR/SPAIR puede considerarse como un tipo de módulo preparatorio que se puede agregar a otras secuencias;
(2) SPIR/SPAIR suprime selectivamente la grasa, mientras que STIR suprime todos los tejidos con valores T1 similares a la grasa.
(3) SPIR/SPAIR sólo se puede realizar en imanes altamente homogéneos.
(4) STIR se utiliza para producir imágenes con contraste similar a T2, SPIR/SPAIR se puede utilizar con secuencias de cualquier ponderación.
(5) Las secuencias SPIR/SPAIR tienen una relación señal-ruido más alta que STIR.
Otros aspectos
Para prótesis de bajo magnetismo (material ortopédico), se recomienda un retraso de 6 a 8 semanas después de la implantación para evitar el desplazamiento del material. Las válvulas cardíacas son generalmente compatibles con la RM.
Gadolineo: se ve hipertenso en la RM. Si la célula no "funciona bien", entonces actúa reteniéndose dentro, sin salir de ella. De esta forma, en los tejidos dañados se produce un aumento de la señal.
De forma MUY general:
T1:
HIPOINTENSO =NEGRO (NO HAY SEÑAL): AIRE, CALCIO, HUESO, SANGRE MUY AGUDA.
GRIS: FLUIDOS, LIGAMENTOS, TENDONES MUSCULOS/
GRIS CLARO: TEJIDOS CARGADOS DE PROTEINAS, ABSCESOS, QUISTES, LIQUIDO SINOVIAL
HIPERINTENSO=ALTA SEÑAL= BLANCO: GRASA, SANGRE, GADOLINO, MELANINA, PROTEINAS.
Cerebro:
-
LCR: Oscuro.
-
Grasa: Brillante.
-
Materia Blanca: Intermedia a brillante.
-
Materia Gris: Intermedia a oscura.
-
Hueso (cráneo): Oscuro.
-
Médula Ósea: Intermedia a brillante.
-
Vasos sanguíneos: Mayormente oscuros; Dependiendo de las características del flujo, puede ser brillante u oscuro.
-
Glándula Pituitaria: Intermedia.
-
Plexo coroideo: Intermedio.
-
Cerebelo: Materia gris más oscura que la sustancia blanca.
-
Tallo encefálico: Intermedio a brillante.
-
Senos paranasales: Oscuros (llenos de aire).
-
Tálamo, Putamen, Hipocampo, Núcleo Caudado: Intermedio.
-
Cuerpo Calloso: Intermedio.
-
Glándula Pineal: Intermedia.
Columna vertebral:
-
Médula Espinal: Intermedia.
-
LCR: Oscuro.
-
Hueso: Oscuro.
-
Médula Ósea: Intermedia a brillante.
-
Disco intervertebral: Intermedio a brillante
-
Ligamentos: Intermedio a Oscuro.
-
Raíces nerviosas: Intermedio.
Abdomen y Pelvis:
-
Hígado: Intermedio a oscuro.
-
Vesícula biliar y conducto biliar común: oscuros.
-
Bazo: Intermedio.
-
Riñón: Intermedio.
-
Uréteres: Intermedio.
-
Páncreas: Intermedio a oscuro.
-
Vejiga urinaria: Oscura.
-
Próstata: Intermedio.
-
Útero: Intermedio.
Musculoesquelético:
-
Músculo: Intermedio.
-
Hueso: Oscuro (señal baja)
-
Médula Ósea: Intermedia a brillante
-
Vasos sanguíneos: Mayormente oscuros; Dependiendo de las características del flujo, puede ser brillante u oscuro.
-
Grasa: Brillante.
-
Ligamentos: Intermedio a oscuro
-
Raíces nerviosas: intermedia
-
Cartílago: Intermedio a oscuro.
-
Líquido sinovial: oscuro.
-
Tendones: Intermedio a oscuro.
T2:
BAJA SEÑAL: AIRE,CALCIO, HUESO CORTICAL, SANGRE RAPIDA
SEÑAL INTERMEDIA-GRIS SOCURO: LIGAMENTOS TENDONES CARTILAGOS// GRIS CLARO: MUSCULO,CARTILAGO, GRASA(QUE A VECES PARECE CASI DE ALTA SEÑAL)
ALTA SEÑAL: FLUIDOS, LCR, GRASA (AUNQUE LIGERAMENTE DE MENOR SEÑAL QUE EN T1)
Cerebro
- Músculo : Intermedio a oscuro.
- Grasa: Muy brillante
- LCR: Intermedio a brillante
- Materia blanca: más oscura que la materia gris
- Materia Gris: Intermedia a brillante
- Hueso: Oscuro (señal baja)
- Médula ósea: variable pero a menudo brillante
- Vasos sanguíneos: Mayormente oscuros, dependiendo de las características del flujo, pueden ser brillantes u oscuros.
- Glándula Pituitaria: Intermedia Plexo Coroides: Intermedio a brillante
- Cerebelo (consta de materia blanca y gris): la materia gris es más brillante que la materia blanca.
- Tallo encefálico: intermedio
- Senos paranasales: Oscuros (llenos de aire)
- Tálamo: más brillante que la materia blanca
- Putamen: Más brillante que la materia blanca
- Glándula Pineal: Intermedia
- Hipocampo: más brillante que la materia blanca
- Cuerpo Calloso: Intermedio a Oscuro
- Núcleo caudado: más brillante que la materia blanca
En los cuerpos vertebrales la distribución de la médula amarilla puede ser en forma de bandas en la proximidad de las placas terminales, como múltiples focos que dan un aspecto parcheado al cuerpo vertebral o como aumento de señal T1 y baja señal en T2 FAT-SAT y STIR de forma homogénea.
Semiología básica:
- Inflamación: Aumentan tiempos de relajación T1 (hipo) y T2 (hiper).
- Neoplasia: Aumenta tiempos de relajación T1 y T2 (señal aumenta) pero MENOS QUE EN INFLAMACIÓN.
- Infiltración grasa: Acorta tiempo de relajación T1(hipointenso).
Hematoma:
- Hb oxigenada: FE de bajo spin→ no paramagnético. Tiempo de relajación alto T1 y T2.
- DesoxiHb (dentro de eritrocitos): FE de alto spin→ paramagnético→ T1 de relajación sigue alto por no interacción espín-espín, pero T2 el tiempo de relajación se reduce.
- Meta intra: FE en forma férrica; muy paramagnética; a pesar de ser intracelular; T1 tambien se relaja.
- Meta extra: En este caso al perder las propiedades de susceptibilidad magnética local se produce el aumento de señal en T2 haciendo que también sea hiperintenso.
- Crónica: Señal similar al agua (pérdida de la señal ferromagnética; lo que queda es agua )
El hematoma agudo es hipointeso T1. Subagudo es hiperintenso periferico y se va haciendo hiperintenso centrípetamente progresivamente. Por otra parte podemos destacar también que la sangre en estado SUBAGUDO va a mostrar hiperintensidad en muchas secuencias: Secuencias potenciadas en T1, secuncias potencidas T2 (si es subagudo tardía) y en difusión.
-----------------------------------------------------------------
- Sustancias repelidas por el campo magnético: diamagnéticas.
- Sustancias atraídas débilmente por el campo magnético: paramagnética.
- Sustancias atraídas fuertemente por el campo magnético: ferromagnética.
La sangre en su evolución cronológica se degrada de oxiHB (diamagnética) a deoxi HB (paramagnética) de tal forma que se puede clasificar la sangre en hiperaguda, aguda, subaguda y crónica.
------------------------------
Principales artefactos en RM
- De movimiento: Imagen desenfocada. Si los movimientos son constantes en misma dirección se produce imagen fantasma.
- Artefactos de flujo: el más habitual es el de la sangre en movimiento que genera un vacío de señal intraluminal en la mayoría de las secuencias.
- Artefacto de cremallera: consiste en una o dos bandas paralelas a lo largo de la dirección de la codificación de fase. Normalmente se producen por presencia de dispositivos magnéticos en la sala. En ocasiones se ve como una banda hiperintensa si interfiere con la señal de radiofrecuencia.
- Fenómeno de aliasing: se debe al uso de un FoV menor del área anatómica a estudiar. Normalmente sucede en la dirección de codificación de fase. Puede provocar que los datos que quedan fuera del FOV aparezcan plegados en el lado opuesto de imagen o en el mismo lado. Algunas soluciones para evitarlo son: aumentar el FOV, cambiar la orientación de fase o activar una herramienta que anula la señal fuera de él llamada oversampling.
- Artefacto de cúspide: Se debe a la excitación del pulso de radiofrecuencia y la subsiguiente detección de la señal de un tejido que se encuentra fuera de los gradientes del campo magnético, es decir, que surge exterior al FOV. Para evitarlo se debe de coincidir la bobina receptora con el valor deseado de FoV.
- Artefacto de truncamiento o de Gibbs: suele aparecer como líneas paralelas adyacentes a interfaces con alto contraste entre sí. Se produce debido a la transformada de Fourier por la cual la imagen se genera a partir de una secuencia finita.
- Artefacto de saturación: Se produce porque el tiempo de repetición es mucho menor que el tiempo de relajación T1. Este artefacto también se produce por superposición de cortes adyacentes. Esto provoca artefacto, sobre todo si se utiliza ángulo de pulso entre 60º y 90º. En los casos en los que se utilice secuencias eco gradientes con ángulos de giro bajo se solucionará este artefacto.
- Artefacto de volumen parcial: Se produce cuando el tamaño del vóxel es tan grande que abarca diferentes tipos de tejidos. Se soluciona con cortes más finos o usando secuencias 3D o disminuyendo el FoV y aumentando el tamaño de matriz.
- Artefacto de excitación cruzada: Se produce cuando el pulso de radiofrecuencia excita protones de tejidos adyacentes. Es poco habitual hoy en día en las máquinas actuales y se caracterizaba por una pérdida de señal en la imagen.
- Artefacto por defecto de homogeneidad del campo magnético: Si hay fallo en la calibración del campo (shining) se producen artefactos principalmente en secuencia de saturación. Esta inhomogeneidad sucede principalmente en zonas de interfase tejido aire. Los artefactos por heterogeneidad del campo magnético se manifiestan como una falta de supresión homogénea de la grasa en un extremo de la imagen en secuencias que incorporan supresión grasa. En algunas máquinas se dispone de una herramienta llamada shimming que ayuda a homogeneizar el campo magnético principal.
- Artefacto de ángulo mágico: Depende del ángulo del colágeno la señal puede variar punto esto sucede principalmente con un ángulo de 55º. Este artefacto no aparece en secuencias con TE largo T2.
- Artefacto por desplazamiento químico: Se produce en la interfase de los tejidos formados por agua y grasa y se debe a que tienen frecuencias de resonancia diferentes. En la imagen de resonancia magnética la posición del vóxel viene determinada por la dirección de codificación de frecuencia del protón. En el caso de que un vóxel se componga por protones de diferente frecuencia de precisión tendrá una localización diferente en el eje de codificación de frecuencia (desplazamiento químico). Por ejemplo, en una imagen en la que haya grasa y agua los protones correspondientes a la grasa generarán una imagen retrasada con respecto a los protones correspondientes al agua, produciéndose una superposición de imágenes a un lado de la interfase mientras que al otro lado habrá un vacío de señal.
Para comprobar el nombre de las secuencias de RM más habituales de los proveedores recomendamos buscar en internet: MRI Cross Vendor Terminology (MRI Acronyms).
------------------------------
Casos de perfusión
- En pacientes con glioblastoma que se valora pseudoprogresion, tras la terapia stupp, si no hay angiogenesis y si crece, entonces es pseudoprogresion seguramente.
- En valoración de lesión tumoral si no recupera linea base en perfusion es característica de malignidad, indica que no tiene permeabilidad suficiente.
- Se considera característico de tumor tener un volumen corregido de más de tres veces con respecto a la sustancia blanca contralateral.
- Volumen sanguineo cerebral relativo mas de 1,7 se considera alto. Perfusion-detecta angiogenesis. La alta perfusion es propio de los de alto grado.
------------------------------
Casos de espectometría
- Ratio colina-creatina se encuentra disminuído en la pseudoprogresión ya que no hay angiogénesis.
- El aumento marcado del pico de lípidos orienta a necrosis. Se suele poner el ROI en los sitios de restricción de la difusión.
- Cociente Colina/creatina alto entonces sugiere tumor. Creatina/NAA alto sugiere tumor (sobre todo en el tiempo alto). Si hay mucho pico de lípidos orienta a que se ha cogido demasiada muestra de necrosis o de hueso.
- En valoración de lesión tumoral si no recupera linea base en perfusión es característica de malignidad, indica que no tiene permeabilidad suficiente.
- Aumento lactato y disminucion de NAA es característico del infarto.
Para la espectro se utilizan dos técnicas de adquisición de volumen: de punto definido(press) y adquisicion de eco estimulado (steam). Estas técnicas se aplican con dos TE diferentes. El corto mejora la relacion S/R.
------------------------------
Anotaciones:
- Metástasis: localización típica es corticosubcortical. Lesion glial es propiamente de sustancia blanca.
- Los vasos serpentiginosos y sangrados intralesionales difusos en un tumor orienta más a glioma que metástasis.
- Para distinguir edema de infiltracion tumoral podemos hacer espectroscopia y perfusión (en el caso de edema por metástasis se visualizará un estado de hipoperfusión).
- Para realizar el estudio de perfusión vamos a utilizar normalmente la perfusión sagital 3d, la perfusión y el MPRAGE.
- La pseudoprogresión ocurre temprano, usualmente en los primeros 3 a 6 meses después de la radioterapia, mientras que la radionecrosis aparece más tarde, meses o años después. La pseudoprogresión es un efecto inflamatorio reversible del tratamiento, mientras que la radionecrosis es un daño irreversible al tejido cerebral causado por la radiación.
- En la valoración del lecho qx tras estirpación de lesión tumoral hay que tener en cuenta el material de hemostasia que existe en el lecho qx, que suele ser HipoT2, HiperT1 ¡y no es sangre! (ver la SWI).
- La necrosis laminar es hiperT1 por la acumulación de grasa. Hay que tener cuidado porque algunos infartos de localización muy cortical (típicamente hemodinámicos ya que la corteza está supeditada a mayor necesidad) suelen ser hiperT2-hipoT1 en la fase aguda.
- Habitualmente en RM no se puede visualizar el IV par.
- El ependimoma no deforma el 4º ventrículo y el meduloblastoma si lo deforma. El meduloblastoma tiene siembra aracnoidea y suele ser hiperdenso en la TC. Ambos pueden calcificar.
- La gliosis a diferencia del edema de la sustancia blanca no produce efecto de masa.
- Infarto lacunar: pequeño infarto que se transforma en quiste, producido por oclusión de pequeña arteria terminal. Más habitual en tálamos, ganglios de la base, cápsula interna. Tiene que ser de mínimo 5 mm.
- En los tumores FLAIR valora la infiltración y el post-contraste valora la ruptura de la barrera hematoencefálica.
- Adenoma hipofisario es heterogéneo T1. Neurohipófisis es hiperintensa T1 y la adenohipófisis como el parénquima cerebral. A veces se hace un dinámico para ver las lesiones. El microadenoma es hipocaptante en la perfusión.
- Astrocitoma pilocítico: No angiogénesis marcada, espectro y perfusión marcadamente agresiva con respecto a lo que cabría pensar para el aspecto del tumor. AUNQUE NO SE PRODUCE AUMENTO DE NAA ya que no se produce
- El linfoma suele tener extensión subependimaria. En la toxoplasmosis puede haber hemorragia sobreañadida más exhuberante que en el linfoma.
- Tumor de bajo grado: captación de contraste pero hipoperfundido (poca angiogénesis). Pico mionositol.
- Angiopatia proliferativa(angiogenesis desorganizada por zonas de isquemia transitoria): malformación arteriovenosa con parénquima interpuesto normal. Normalmente afecta a más territorio, incluso atectando a lóbulo entero. Las venas en una sola adquisición no aparecen. No suelen sangrar. Está siempre alimentado de varias arterias en vez de una dominante.
- ¿Secuencias Spin Eco para valoración de metástasis?: Los vasos se ven oscuros y por tanto en secuencias con administración de contraste son mejor para diferenciar vasos de meninges. El Spin Eco Cube T1 se está utilizando para ver captaciones sugerentes de metástasis mejor que el ecogradiente ya que en esta última secuencia los vasos se ven blancos.
- Meningioma al carecer de BHE posee una perfusión máxima, prácticamente similar a los vasos.
EFECTOS:
- Efecto T2/FLAIR mismatch sign: Especialmente útil para el diagnóstico de gliomas de bajo grado y en aquellos con IDH mutado (formación de microqusites?--> interpretación de líquido libre). Cociento alto T2/FLAIR---》el FLAIR cae la señal porque lo interpreta como líquido libre.
- EFECTO T2 shine-through- también llamado efecto T2 (blanco en ADC y blanco en mapa b; te quedas sin saber si restringue o no la difusión)". ESTO lo podemos solucionar mirando el mapa ADC. El mapa B0- es un mapa tipo T2 que te permite saber de base "lo que se mueve y no se mueve". Efecto apagado: Oscuro en DWI y en ADC debido a la hipercelularidad del tejido. Se da en lesiones por lo general agresivas, como el linfoma, donde cabría esperar valores altos en DWI, pero debido a la hipercelularidad se da este fenómeno paradójico. Se acompaña de señal T2 y FLAIR baja por lo general
- EFECTOS EN LA PERFUSIÓN: * Fenómeno de secuestro en la perfusión: La curva no recupera su nivel basal por déficit de lavado de Gadolíneo. Esto es habitual en los tumores. * Por otra parte se conoce como Efecto T1 a precisamente lo contrario.
