Clínica de la enfermedad
Los ictus los podemos clasificar etiológicamente en:
Ictus isquémicos: Según su causa los dividimos en:
- Trombóticos: Afectación normalmente de la arteria carótida común
- Émbolos: Afectan más frecuentemente a la arteria cerebral media.
- HTA: Afectación de pequeño vaso.
- Bajo flujo.
Ictus hemorrágicos:
- HTA: Por generación de microaneurismas de pequeño vaso
- MAV (malformación arteriovenosa)
- Amiloides: Suelen ser infartos lobares
- Extraparenquimatosos: Subaracnoideos, epidurales o subdurales.
Los ictus isquémicos los podemos clasificar según localización y extensión en (escala de Oxfordshire):
- Infartos que afectan a la circulación anterior: Carótida interna y sus ramas. Mayormente la arteria cerebral media
- Infartos que afectan a la circulación posterior: Circulación vertebrobasilar. Las estructuras dañadas son cerebelo, troncoencéfalo, tálamo y lóbulo occipital.
- Infartos del sistema perforante: Son los conocidos como infartos lacunares. Ramas provenientes de la arteria coroidea, polígono de Willis y arteria basilar.
- Infartos frontera.
Vascularización:
- Ramas de la arteria carótida interna: Destacan cerebral media, cerebral anterior y comunicante posterior. Otras ramas más pequeñas son la oftálmica y la coroidea anterior.
- Ramas de la basilar: Arteria cerebelosa superior y arteria cerebelosa anteroinferior.
- Ramas de las arterias vertebrales: PICA ( arteria cerebelosa posteroinferior).
Homúnculo de Penfield:
Otra clínica importante a tener en cuenta:
- Afasia motora: Giro frontal inferior –opercular// - Afasia sensitiva:Giro temporal superior y supramarginal
- Ganglios basales: Corea, atetosis, distonía, síndromes extrapiramidale/// - Tálamo: Hemianestesia contralateral, déficits sensoriales parcheados, coma/// - Afectación muy importante del nivel de conciencia y el equilibrio: pensar en afectación de arteria de la basilar.//- Giro precentral: Hemiparesia-plejía contralateral (homúnculo de Penfield)//- Giro poscentral: Hemihipoestesia contralateral (homúnculo de Penfield)
Principales hallazgos
El protocolo a seguir en un estudio por código ictus incluye:
- TC sin contraste: La determinación de sangre en el estudio hace innecesaria la continuación del mismo.
- Estudio de perfusión: Tras la administración de un bolo corto (50 ml) y a alto flujo de contraste (4-5ml/sg) se adquieren imágenes continuas, con un retraso de 5 s y durante 45-60 s, dinámicas, sobre la misma porción de cerebro, obteniéndose los mapas de perfusión. Solo estudia un área del cerebro, la cual debe decidirse según clínica del paciente. Sirve para detectar simuladores de infarto y valora adecuadamente las colaterales.
- AngioTC de troncos: Localiza trombo y visualiza colaterales.
Hay que tener en cuenta que la TC tiene una baja sensibilidad durante las primeras 3 h para detectar los signos de isquemia pero aumenta hasta el 60% cuando se llega a las 6h.
Signos:
TENER EN CUENTA QUE DE FORMA GENERAL LA SUSTANCIA BLANCA SE VE MÁS HIPODENSA QUE LA GRIS
- Los signos en la TC sin contraste son básicamente: Hipodensidad, borrosidad de los surcos en la zona afectada, desdiferenciación de la sustancia blanca y negra. Podemos ver tambien otro signo conocido como el del vaso hiperdenso por la presencia de trombo.
- En la TC con contraste: Podemos localizar el trombo. Ventana adecuada para la valoración de W 25/35 UH.
- Por otra parte la TC es fundamental para la determinación del tamaño del área afectada por el infarto.
- En ictus reciente LA SUSTANCIA BLANCA Y GRIS SE IGUALAN EN DENSIDAD. CUANDO LA SUSTANCIA GRIS SE HACE HACE MÁS HIPODENSA QUE LA BLANCA Y SE BORRAN SURCOS ENTONCES ES UN INFARTO YA ESTABLECIDO.
- Lesión isquémica crónica: Adicionalmente a la alta hipodensidad de la lesión tener en cuenta también que en las lesiones crónicas se produce la retraccción del ventrículo adyacente, y RETRACCIÓN DE SURCOS junto con sustitución malácica.
- Contusión: Originadas por el golpe o el contragolpe. Por lo general la contusión se manifiesta por un foco hipodenso asociado a discreto edema con una distribución preferente adyacente zonas de choque con los huesos del craneo: peñascos, el frontal y los lóbulos temporales y en el techo de la órbita ocular. Tener cuidado con las contusiones asociadas a hemorragia que se ven como lesiones hiperdensas.
La escala de ASPECTS valora en la TC sin contraste y con contraste (en la actualidad con mayor importancia en la TC sin contraste) signos precoces de isquemia en los segmentos irrigados por la arteria cerebral media (solo sirve para la valoración de los territorios vasculares irrigados por dicha arteria). Define 10 regiones en dos niveles: gangliónico y supragangliónico con límite en la cabeza del núcleo caudado. Una puntuación de 10 indica que no existe alteración, mientras que una puntuación por debajo de 6 hace baja la probabilidad de mejora.
- A NIVEL DE LOS GANGLIOS DE LA BASE /GANGLIÓNICO: •Núcleo caudado . •Núcleo Lenticular. • Cápsula interna . • Ribete insular • Territorio dependiente de la ACM: opérculo frontal (M1). • Territorio lóbulo temporal anterior (M2). • Territorio lóbulo temporal posterior (M3).
- A NIVEL SUPRAGANGLIONAR: • Superior a M1 (M4) • Superior a M2 (M5) • Superior a M3 (M6)
La escala de PC-ASPECTS: Equivalencia del ASPECTS para la circulación posterior. Tenemos que valorar principalmente:• tálamo- • protuberancia- • mesencéfalo- • lóbulo occipital y • cerebelo.
- PC-ASPECTS también tiene una puntuación de 10 puntos, pero cualquier afectación protuberancial o del mesencéfalo reduce la puntuación en 2 puntos independientemente de la presentación uni/bilateral.
Otros aspectos interesantes
Inteligencia artificial:
Actualmente realiza cálculo del ASPECT en TC sin contraste, grado de colateralidad, cálculo de core y la penumbra en el estudio de perfusión.
AngioTC:
* Una zona con una aparente oclusión completa pero con una muy buena repleción distal de contraste orienta a placa de ateroma con complicación trombótica. Muy interesante evaluar zonas distales a dicha placa por si se ha producido la emisión de émbolos distales.
Perfusión:
Conceptos:
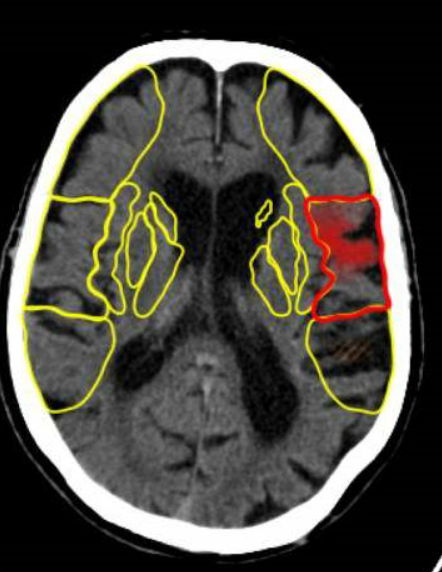
Core isquémico: Área infartada necrótica no susceptible de mejora tras la revascularización. SI CORE DE INFARTO MÁS DE 100 mm SUELE SER ASPECT MENOR DE 4 Y NO ES REVASCULARIZABLE. Actualmente la zona de infarto es señalada en los programas de software en rojo por lo general.
Penumbra: Territorio hipoperfundido, adyacente al core, que en el caso de una pronta revascularización mejora. SON ZONAS en los software actuales señaladas en VERDES.
Missmatch: Discordancia entre área en penumbra y el core. SI SALE MÁS DE 1,2 ENTONCES ESTÁ INDICADA LA REVASCULARIZACIÓN (se tienen en cuenta más factores adicionales como el estado de las colaterales).
Tiempos importantes:
•Volumen sanguíneo cerebral (CBV): Consiste en el volumen sanguíneo por unidad de masa cerebral.
• Flujo sanguíneo cerebral (CBF): Volumen de sangre que fluye por unidad de masa cerebral en un intervalo de tiempo de 1 minuto.
• Tiempo de tránsito medio (MTT): Muestra la diferencia de tiempo entre la llegada del flujo arterial y la salida del flujo venoso. Nos da información del funcionamiento de la microvasculatura.
• Tiempo hasta el pico (TTP): Indica el tiempo que hay entre la administración de contraste y el punto de mayor intensidad.
• Tiempo máximo (Tmax): refleja el tiempo de retraso para que el bolo de contraste le llegue a la circulación arterial proximal y al parénquima cerebral.
Modificaciones de los tiempos:
Patrón de hiperperfusión: caracterizado por un acortamiento de los valores de MTT/Tmax/TTP, un aumento de los valores de CBF y valores de CBV normales o incrementados. Casos de hiperperfusión: Crisis epiléptica (fase ictal).Gliomas de alto grado.Síndrome de Encefalopatía Posterior Reversible (PRES). Síndrome de Reperfusión/Hiperperfusión. Encefalitis viral.
Patrón de hipoperfusión: caracterizado por una prolongación de los valores de MTT/Tmax/TTP, una disminución de los valores de CBF y valores de CBV normales o disminuidos. Ejemplos de hipoperfusión: Accidente isquémico transitorio (AIT). Vasoespasmo. Estenosis carotídea bilateral. Trombosis venosa cerebral. Migraña con aura. Hipoglucemia. Fístula Arterio-Venosa Dural.
Intermedios: Ejemplos: Infartos crónicos y “perfusión de lujo”. Infartos lacunares. Diasquisis cerebelosa cruzada. Artefactos por movimiento. Curvas de atenuación-tiempo arterial y venosa. Valores umbral en los mapas de color. Software de post-procesado.
Modificaciones de los tiempos en ictus
BAJO: Flujo sanguíneo cerebral (CBF)
ALTO: Tiempo hasta el pico (TTP), del tiempomáximo (Tmax) y del tiempo de tránsito medio (MTT). Consideramos un tiempo de tránsito medio proprio de infarto:>14 s aproximadamente. Un tiempo normal es de 3-4 segundos. Y elevado pero no en rango de infarto (7-8s) ante situaciones de no oclusión completa.
¿Alto TTM con volumen cerebral conservado sin encontrar defecto de repleción en el estudio de AngioTC ?: puede producirse porque el vaso se ha repermeabilizado antes de hacer el estudio y estamos viendo un efecto de reperfusión, en el estudio en vacío podemos ver imagen propia de infarto establecido.
-------------------------
* Penumbra: Alta sospecha de isquemia con volumen sanguíneo cerebral (CBV) normal o ligeramente aumentado. Cuando los valores de CBV disminuyen por debajo de los valores normales, entonces estas regiones cerebrales muestran una alta probabilidad de infarto irreversible, y se les conoce como "núcleo" de infarto:
-----------------------
Patrón de hiperperfusión de lujo: Se produce sobre el área de penumbra del infarto en casos en los que ha habido una reperfusión. Surge por proliferación de capilares y venas que se vasodilatan. Aumenta su flujo y la permeabilidad pudiendo en ocasiones presentar un realce (sobre todo en córtex-realce giral. En otras ocasiones es más periférico-realce en anillo) o aumento de la atenuación. En la perfusión de lujo existe un flujo cerebral aumentado por encima de los requerimientos tisulares de O2, lo que conduce a una extracción de O2 reducida y a la aparición de una red de sangre venosa. Se caracteriza por: Disminución de los valores de MTT / Tmax / TTP por la derivación arteriovenosa, aumento de los valores de CBF y valores de CBV normales o incrementados. El patrón de hipoperfusión se presenta como justo al contrario (se da en muchas otras causas aparte de la lesión isquémica como pudiera ser el AIT, vasoespasmo, estenosis carotídeas, trombosis venosa...)
-----------------------
Cuidado con la perfusión mostrada por software: En ocasiones la perfusión mostrada por estos softwares puede fallar. Ejemplo de ello puede ser situaciones en donde la TC sin contraste muestre un área marcadamente hipodensa en relación con infarto establecido. La perfusión mostrada por estos softwares puede mostrar zona de perfusión reducida, pero no de "core". Nosotros podemos realizar una perfusión manual que puede mostra un volumen cerebral aumentado. Esto puede estar en relación con una zona de perfusión de lujo (restablecimiento de la vascularizacón), pero el infarto ya está esteblecido.
El ASPECT automático tambien puede fallar. Hay que tener en cuenta que estos métodos habitualmente comparan con la zona contralateral. Por ejemplo, si la zona contralateral estaba antiguamente infartada la zona actual en revisión puede aparecer erroneamente normal.
En otras ocasiones, en una etapa precoz del ictus isquémica, la perfusión puede sobreestimar el core de infarto debido a que todavía no se ha desarrollado la colateralidad suficiente. Esto suele ocurrir en las primeras 3 horas del infarto.
Disección:
Afilamiento progresivo de la luz con aumento del diámetro arterial, lo más frecuente. Disminución de calibre de la luz verdadera que está rodeada de un engrosamiento parietal con morfología en media luna: muy específico pero poco sensible.
¿Complicación postrombectomía?:
- En ocasiones se puede presentar clínicamente como síndrome por reperfusión; en cuyo caso en necesario un TC de perfusión.
- La principal complicación que debemos descartar es la presencia de: SANGRADO VS CONTRASTE POSTROMBECTOMÍA Y SD REPERFUSIÓN. Si disponemos de TC dual su ayuda será indiscutible para distinguir entre SANGRADO VS CONTRASTE POSTROMBECTOMÍA. La sangre a diferencia del contraste, se va a presentar en cantidad superior y por tanto con mayor incidencia de efecto masa y edema perilesional. Cuando exista duda en diferenciar de ambas entidades será necesario realizar un estudio de control.
Por otra parte el síndrome por reperfusión se presenta en la TC sin contraste sobre todo por edema de sustancia blanca en la zona reperfundida.
¿Ictus cortical?:
Pequeños borramientos corticosubcorticales
¿Oclusión en tándem?:
La lesión en tándem , u oclusión en tándem , es un término utilizado en imágenes e intervenciones cerebrovasculares para referirse a la presencia simultánea de estenosis u oclusión de alto grado de la arteria carótida interna cervical y oclusión tromboembólica de la arteria carótida interna terminal intracraneal o sus ramas, generalmente la arteria cerebral media , en el contexto de un accidente cerebrovascular isquémico agudo.
¿Disección u oclusión carotídea...?:
- Oclusión: Parada abrupta del contraste iv.
- Disección: Lo más frecuente es que produzca una imagen en llama. Normalmente la disección se produce extracranealmente con oclusión completa de la luz por compresión extrínseca de la falsa luz sobre la verdadera. La oclusión intracrenal por disección se produce habitualmenteor migración del trombo de la luz falsa que se abre a la luz verdadera y acaba taponando la arteria a nivel intracraneal. En otras ocasiones provoca un afilamiento progresivo de su luz. La luz de la carótida verdadera se encuentra estrechada distalmente, por el contrario, la luz total de la carótida está aumentada distalmente. No suele extenderse intracranealmente.
La arteria hipoplásica V4 normalmente da la PICA antes. En el caso de la disección no suele dar la PICA antes. Además la luz es más irregular asociando ensanchamientos y estrecheces. La disección una vez dada la PICA da un hipoperfusión de tronco en territorio perforante ya que no hay colaterales en dicho nivel.
- Suboclusión: Imagen clave en pintura de agua. Se produce por una oclusión más craneal que provoca que el contraste no llegue porque la sangre está remansada. Esto simula una oclusión de la parte cervical inferior de la carótida interna, pero en realidad es el resultado de una parada en la parte superior de la carótida
- Web carotideo: Tejido fibroso que produce una protusión en la luz. Muy frecuente localizado en el bulbo carotídeo. Imágenes coronales y sagitales son clave para su diagnóstico
¿Ictus venoso?:
Hallazgos
- Hiperdensidad del seno o vena cortical en TC sin contraste. Cuidado en pacientes jóvenes, que de por sí se aprecia una hiperdensidad relativa.
- Ausencia de repleción del seno venoso en el estudio con contraste iv.
- Edema cortical asociado en zona atípica; parasagital superior, basal bilateral o temporal periférica (trombosis de vena de Labbé).
- Hemorragia lobar de localización atípica.
** Cuidado con las variaciones anatómicas normales de los senos. Por ejemplo, un seno transverso hipoplásico asociará un agujero yugular pequeño.
Medición de la estenosis:
Para su cálculo debemos medir la estrechez angulando para seguir el eje correcto del vaso. La medición distal se realizara a 6 cm de la esteneosis.
NASCET se estableció mediante el cálculo angiográfico del porcentaje de estenosis de la ACI utilizando la siguiente fórmula:
- % de estenosis de ICA = (1 - [diámetro de ICA más estrecho/diámetro de ICA cervical distal normal]) x 100
La estenosis del más de 80% se recomienda como indicación para endartectomía.
Peculariedades del paciente
Virchow-Robin
A veces es difícil distinguir entre una lesión isquémica crónica o espacios perivasculares agrandados (espacios de Virchow-Robin).
A la hora de distinguir entre espacios de Virchow-Robin e infartos cronicos podemos utilizar diferentes herramientas del software de imagen. Podemos utilizar las reconstrucciones multiplanares,hacer uso del MPR. Normalmente si las lesiones en las que dudamos se localizan en tercio inferior de globos pálidos serán seguramente espacios Virchow-Robin. A la altura, en concreto, de la comisura anterior, suelen tratarse de dichos espacios.
TAMBIÉN PUEDEN EXISTIR ESTOS ESPACIOS EN EL TRONCOENCÉFALO. Existe una clasificación de la disposición de los espacios de Virchow Robin: I: Sublenticulares II: Capsulares-hemisféricos (territorio perforante) III: mesencefálico-troncoencefálico/// (hipointenso en T1 y FLAIR, e hiperintenso en secuencias potenciadas en T2).
Es complicado también distinguir entre un hematoma subdural crónico y un higroma subdural:
Ambos se ven como colecciones hipodensas extraaxiales. En muchos casos se requiere una RM (valorando la secuencia FLAIR) para diferenciarlos en el caso de que no dispongamos de estudios previos que valoren la existencia de hematomas subdurales agudos.
No hay que menospreciar la diferenciación entre la atrofia cerebral (valorar el signo de la vena cortical positiva; presente en la atrofia) y el hematoma subdural crónico (surcos aplastados, pueden existir asociado tabicaciones hiperdensas que hay que distinguir de la vena cortical.)
Ictus hemodinámicos previos: Por oclusión de carótida
Se aprecian en la prueba como lesiones isquémicas crónicas distribuídas por territorio frontera.
¿Lesión isquémica crónica?
Las hipodensidades distribuídas por nucleos lenticulares y de otra localización no descritas en estudios previos se describen rápidamente como lesiones isquémicas crónicas . Esto, en algunos casos es precipitado ya que no sabemos si esa área encefalomalácica ha sido debido a infarto previo o ha sido debido a un sangrado previo y se deben señalar de una forma más simple como áreas encefalomalácicas únicamente (más aún cuando el paciente es joven por ejemplo o no posee elevados factores de riesgo asociado para que presente lesiones isquémicas).
¿Degeneración Walleriana?
La degeneración walleriana es el proceso de degeneración anterógrada de los axones y sus vainas de mielina acompañantes debido a una lesión proximal del cuerpo celular axonal o neuronal. Puede producirse tras una pérdida neuronal debido a un infarto cerebral , un traumatismo , una necrosis, una desmielinización focal o una hemorragia
La distribución de la degeneración walleriana depende de la región lesionada y de cómo se relaciona con los tractos de sustancia blanca que allí se originan. El patrón observado con más frecuencia es una lesión en el giro precentral.
Puede afectar tantoa craneal como a caudal dependiendo de donde se encontraba la lesión.
TC: La TC no es tan sensible como la RMN y la degeneración walleriana generalmente se observa solo en su etapa crónica. Se observa como un tracto contiguo de gliosis que se extiende desde una región de lesión neuronal cortical o subcortical hacia las estructuras cerebrales profundas. Puede producirse por ejemplo atrofia peduncular.
¿Caracterización temporal de la lesión?
Se considera lesión isquémica crónica aquella lesión isquémica de más de 30 días de evolución. Subaguda: 7-30 d. Aguda: <7 días.
Ictus de tiempo desconocido:
Tiempos del ictus:1) Fasea aguda: 24 horas siguientes a su instauración.
2) Fase aguda tardía: 1 y 6 días después de producido el infarto (*Mención especial en este apartado merece el infarto cerebeloso, que es muy poco frecuente, pero cuando se produce se suele acompañar de un importante efecto compresivo sobre el cuarto ventrículo, dando lugar a la aparición). 3)Fase subaguda: Comprende entre los 5 y los 30 días siguientes. Puede aparecer captación en la zona infartada y perfusión de lujo. 4)Fase crónica:
En ocasiones ante un ictus de tiempo desconocido y un AngioTC dudoso se puede plantear la realización de una RM para valorar si el paciente es candidato a la realización de trombectomía ya que la RM discrimina mejor la zona en penumbra.
EN LA RM LAS SECUENCIAS IMPRESCINDIBLES SON: DIFUSIÓN Y FLAIR, SUSCEPTIBILIDAD Y 3D TOF. IMPORTANTE TENER EN CUENTA QUE TE LO SUELE SER UNA PETICIÓN REQUERIDA EN INFARTOS DE TIEMPO DESCONOCIDO. EN EL CASO DE LA DIFUSIÓN PUEDE APARECER AFECTACIÓN PERO MIENTRAS NO APAREZCA EN LA SECUENCIA FLAIR QUIERE DECIR QUE LA ZONA ES SALVABLE.
Fenómeno de Fogging:
El fenómeno de empañamiento se observa en la tomografía computarizada o resonancia magnética del cerebro sin contraste y representa una fase transitoria de la evolución del infarto cerebral donde la región del infarto cortical recupera una apariencia casi normal.
Entre 2 y 3 semanas después de un infarto, la corteza recupera una densidad casi normal y las imágenes obtenidas en este momento pueden generar confusión o no diagnosticar. Se ha demostrado que la corteza se empaña en alrededor del 50 % de los casos. En caso de duda, la administración de contraste intravenoso demarcará la región del infarto.
Se cree que se debe a migración de macrófagos y leucocitos cargados de lípidos al tejido infartado, la proliferación de capilares, la extravasación de glóbulos rojos de los capilares dañados y una disminución del edema.
-----------
Tipos de edema:
- Edema vasogénico: Típico de los estados postquirúrgicos. Por lesión de las paredes vasculares/lesión en barrera hematoencefálica, existiendo mayor permeabilidad del aguda
- Edema transpependimario de tipo intersticial o también llamado hidrostático: Adyacente los ventrículos que se encuentran comprimidos u obstruídos. Por el aumento de presión que se produce que provoca una fuerza del líquido hacia el intersticio adyacente. Un subtipo sería el edema compresivo, por obstrucción del drenaje venoso, por ejemplo, por meningiomas.
- Edema citotóxico: El producido en la isquemia, convulsiones, en general, en procesos asociados a hipoxia celular. Se produce por el daño en la bomba sodio-potasio. La célula acaba dañándose y muriendo provocando su hinchazón y relleno de agua.